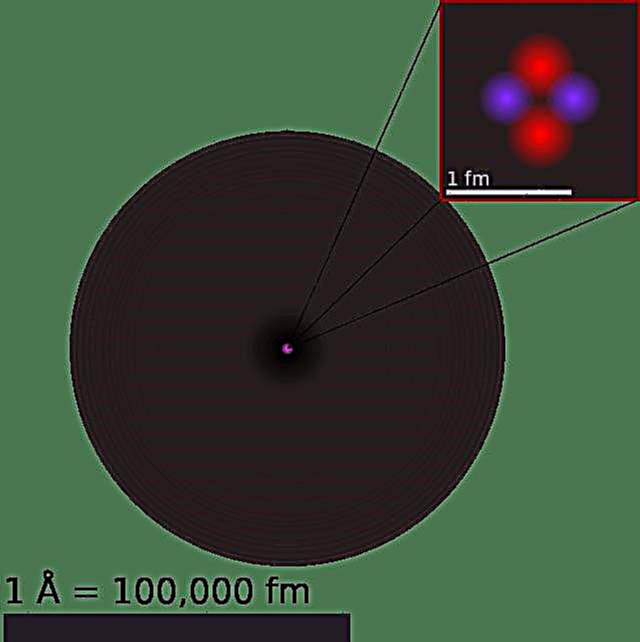
Teoria atomică a parcurs un drum lung în ultimele câteva mii de ani. Începând din secolul V î.Hr., cu teoria lui Democrit despre „corpuscule” indivizibile care interacționează mecanic între ele, trecând apoi pe modelul atomic al lui Dalton în secolul al XVIII-lea, apoi maturizându-se în secolul XX cu descoperirea particulelor subatomice și teoria cuantică, călătoria descoperirii a fost lungă și șerpuitoare.
Probabil, una dintre cele mai importante repere de-a lungul drumului a fost modelul atomic al lui Bohr, care este uneori denumit model atomic Rutherford-Bohr. Propus de fizicianul danez Niels Bohr în 1913, acest model prezintă atomul ca un nucleu mic, încărcat pozitiv, înconjurat de electroni care călătoresc pe orbitele circulare (definite de nivelurile lor energetice) în jurul centrului.
Teoria atomică până în secolul al XIX-lea:
Cele mai cunoscute exemple de teorie atomică provin din Grecia și India antică, unde filosofi precum Democrit au postulat că toată materia era compusă din unități minuscule, indivizibile și indestructibile. Termenul „atom” a fost inventat în Grecia antică și a dat naștere școlii de gândire cunoscută sub numele de „atomism”. Cu toate acestea, această teorie era mai mult un concept filosofic decât unul științific.
Abia în secolul al XIX-lea, teoria atomilor a devenit articulată ca materie științifică, primele experimente bazate pe dovezi fiind efectuate. De exemplu, la începutul anilor 1800, savantul englez John Dalton a folosit conceptul de atom pentru a explica de ce elementele chimice au reacționat în anumite moduri observabile și previzibile. Printr-o serie de experimente care au implicat gaze, Dalton a continuat să dezvolte ceea ce este cunoscută sub numele de Teoria atomică a lui Dalton.
Această teorie s-a extins pe legile conversației de masă și proporții definite și a ajuns la cinci premise: elementele, în starea lor cea mai pură, constau din particule numite atomi; atomii unui anumit element sunt aceiași, până la ultimul atom; atomii de diferite elemente pot fi deosebite de greutățile lor atomice; atomii elementelor se unesc pentru a forma compuși chimici; atomii nu pot fi creați sau distruși în reacție chimică, doar gruparea se schimbă vreodată.
Descoperirea electronului:
Până la sfârșitul secolului 19, oamenii de știință au început, de asemenea, să teoretizeze că atomul era format din mai mult de o unitate fundamentală. Cu toate acestea, majoritatea oamenilor de știință s-au aventurat că această unitate ar fi de dimensiunea celui mai mic atom cunoscut - hidrogenul. Până la sfârșitul secolului 19, acest lucru s-ar schimba drastic, datorită cercetărilor efectuate de oameni de știință precum Sir Joseph John Thomson.
Printr-o serie de experimente folosind tuburi cu raze catodice (cunoscut sub numele de "Crookes" Tube), Thomson a observat că razele catodice pot fi deviate de câmpuri electrice și magnetice. El a concluzionat că, în loc să fie compuse din lumină, acestea erau formate din particule încărcate negativ, care erau de 1 ori prea mici și de 1800 de ori mai ușoare decât hidrogenul.

Acest lucru a respins efectiv ideea că atomul de hidrogen este cea mai mică unitate de materie și Thompson a mers mai departe pentru a sugera că atomii sunt divizibili. Pentru a explica încărcarea generală a atomului, care consta atât din sarcini pozitive cât și din cele negative, Thompson a propus un model prin care „corpusculele” încărcate negativ erau distribuite într-o mare uniformă de încărcare pozitivă - cunoscut sub numele de modelul de budincă.
Aceste corpuscule vor fi numite mai târziu „electroni”, bazate pe particulele teoretice prezise de fizicianul anglo-irlandez George Johnstone Stoney în 1874. Și din aceasta s-a născut modelul Plum Pudding, numit astfel pentru că seamănă îndeaproape cu deșertul englez care este format din prăjitură cu prune și stafide. Conceptul a fost introdus în lume în ediția din martie 1904 a Regatului Unit Revista filozofică, la aclamație largă.
Modelul Rutherford:
Experimentele ulterioare au scos la iveală o serie de probleme științifice cu modelul Plum Pudding. Pentru început, a existat problema de a demonstra că atomul posedă o încărcare uniformă pozitivă de fond, care a fost cunoscută sub numele de „Problema Thomson”. Cinci ani mai târziu, modelul va fi respins de Hans Geiger și Ernest Marsden, care au efectuat o serie de experimente folosind particule alfa și folie de aur - aka. „experimentul cu folie de aur”.
În acest experiment, Geiger și Marsden au măsurat modelul de împrăștiere a particulelor alfa cu un ecran fluorescent. Dacă modelul lui Thomson ar fi corect, particulele alfa ar trece prin structura atomică a foliei fără obstacole. Cu toate acestea, au remarcat în schimb că, în timp ce majoritatea împușcau direct, unele dintre ele erau împrăștiate în diverse direcții, iar unele se întorceau în direcția sursei.

Geiger și Marsden au ajuns la concluzia că particulele au întâlnit o forță electrostatică mult mai mare decât cea permisă de modelul lui Thomson. Deoarece particulele alfa sunt doar nuclee de heliu (care sunt încărcate pozitiv), acest lucru a presupus că sarcina pozitivă în atom nu a fost dispersată pe scară largă, ci concentrată într-un volum mic. În plus, faptul că acele particule care nu au fost deviate au trecut prin neimpediat a însemnat că aceste spații pozitive au fost separate de vaste goluri de spațiu gol.
Până în 1911, fizicianul Ernest Rutherford a interpretat experimentele Geiger-Marsden și a respins modelul de atom al lui Thomson. În schimb, el a propus un model în care atomul era alcătuit din spațiu în mare parte gol, cu toată încărcătura pozitivă concentrată în centrul său într-un volum foarte mic, care era înconjurat de un nor de electroni. Acesta a fost cunoscut sub numele de modelul Rutherford al atomului.
Modelul Bohr:
Experimentele ulterioare ale lui Antonius Van den Broek și Niels Bohr au perfecționat modelul în continuare. În timp ce Van den Broek a sugerat că numărul atomic al unui element este foarte similar cu sarcina nucleară a acestuia, acesta din urmă a propus un model de atom de tipul sistemului solar, unde un nucleu conține numărul atomic de sarcină pozitivă și este înconjurat de un egal numărul de electroni în cochilii orbitali (de asemenea, modelul Bohr).
În plus, modelul lui Bohr a rafinat anumite elemente ale modelului Rutherford care au fost problematice. Acestea includeau problemele care decurg din mecanica clasică, care prevedea că electronii vor elibera radiații electromagnetice în timp ce orbitau un nucleu. Din cauza pierderii de energie, electronul ar fi trebuit să spire rapid spre interior și să se prăbușească în nucleu. Pe scurt, acest model atomic presupunea că toți atomii erau instabili.

Modelul a prezis, de asemenea, că, pe măsură ce electronii spirală spre interior, emisia lor va crește rapid în frecvență, pe măsură ce orbita se micșora și mai rapid. Cu toate acestea, experimentele cu descărcări electrice de la sfârșitul secolului XIX au arătat că atomii emit numai energie electromagnetică la anumite frecvențe discrete.
Bohr a rezolvat acest lucru propunând ca electronii să orbiteze nucleul în moduri compatibile cu teoria cuantică a radiației. În acest model, electronii pot ocupa doar anumite orbite permise cu o energie specifică. Mai mult decât atât, acestea pot câștiga și pierde energie numai sărind de pe o orbită permisă în alta, absorbind sau emitând radiații electromagnetice în acest proces.
Aceste orbite au fost asociate cu energii definite, la care a făcut referire coji de energie sau nivelurile de energie. Cu alte cuvinte, energia unui electron din interiorul unui atom nu este continuă, ci „cuantificată”. Aceste niveluri sunt astfel etichetate cu numărul cuantic n (n = 1, 2, 3 etc.) pe care el a afirmat-o ar putea fi determinat folosind formula Ryberg - o regulă formulată în 1888 de fizicianul suedez Johannes Ryberg pentru a descrie lungimile de undă ale liniilor spectrale ale multor elemente chimice.
Influența modelului Bohr:
În timp ce modelul lui Bohr s-a dovedit a fi inovator în anumite privințe - fuzionarea constantă a lui Ryberg și constantă a lui Planck (de asemenea, teoria cuantică) cu modelul Rutherford - a suferit din cauza unor defecte pe care experimentele ulterioare le-ar ilustra. Pentru început, s-a presupus că electronii au atât o rază cât și o orbită cunoscută, lucru pe care Werner Heisenberg l-ar contesta un deceniu mai târziu cu Principiul său de incertitudine.
În plus, deși a fost util pentru a prezice comportamentul electronilor în atomii de hidrogen, modelul lui Bohr nu a fost deosebit de util în prezicerea spectrelor de atomi mai mari. În aceste cazuri, în care atomii au mai mulți electroni, nivelul de energie nu a fost în concordanță cu ceea ce a prezis Bohr. De asemenea, modelul nu a funcționat cu atomi neutri de heliu.
Modelul Bohr nu a putut contabiliza nici efectul Zeeman, fenomen remarcat de fizicienii olandezi Pieter Zeeman în 1902, unde liniile spectrale sunt împărțite în două sau mai multe în prezența unui câmp magnetic static, static. Din această cauză, s-au încercat mai multe rafinări cu modelul atomic al lui Bohr, dar acestea s-au dovedit a fi problematice.
În cele din urmă, acest lucru ar duce la ca modelul lui Bohr să fie înlocuit de teoria cuantică - în concordanță cu munca lui Heisenberg și Erwin Schrodinger. Cu toate acestea, modelul lui Bohr rămâne util ca instrument de instrucțiune pentru introducerea studenților la teorii mai moderne - cum ar fi mecanica cuantică și modelul atomic al cochiliei de valență.
De asemenea, s-ar dovedi o etapă importantă în elaborarea modelului standard al fizicii particulelor, un model caracterizat prin „nori de electroni”, particule elementare și incertitudine.
Am scris multe articole interesante despre teoria atomică aici la Space Magazine. Iată modelul atomic al lui John Dalton, care este modelul de budincă de prune, care este modelul de electroni în cloud? Cine a fost Democrit și care sunt părțile atomului?
Astronomy Cast are și câteva episoade pe subiect: Episodul 138: Mecanica cuantică, Episodul 139: Niveluri de energie și spectre, Episodul 378: Rutherford și atomii și Episodul 392: Modelul standard - Intro.
surse:
- Niels Bohr (1913) „Cu privire la Constituția atomilor și moleculelor, partea I”
- Niels Bohr (1913) „Cu privire la Constituția atomilor și moleculelor, partea a II-a sisteme care conțin doar un singur nucleu”
- Encyclopaedia Britannica: Borh Atomic Model
- Hiperfizica - Modelul Bohr
- Universitatea din Tennessee, Knoxville - Modelul Borh
- Universitatea din Toronto - Modelul Bohr al atomului
- NASA - Imaginați-vă Universul - Istoric: Atomi și energie lumină
- Despre educație - Bohr Modelul Atomului