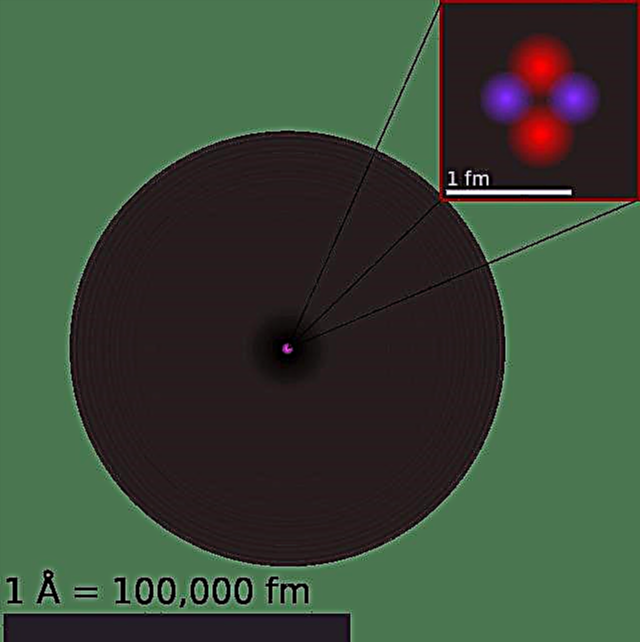
Încă de la începutul timpului, ființele umane au căutat să înțeleagă din ce este format universul și tot ceea ce se află în el. Și în timp ce magii și filozofii antici au conceput o lume compusă din patru sau cinci elemente - pământ, aer, apă, foc (și metal sau conștiință) - din antichitatea clasică, filozofii au început să teoretizeze că toată materia era de fapt formată din minuscule, atomi invizibili și indivizi.
De atunci, oamenii de știință s-au angajat într-un proces de descoperire continuă cu atomul, în speranța de a descoperi adevărata sa natură și machiaj. Până în secolul XX, înțelegerea noastră a devenit rafinată până la punctul în care am putut să construim un model precis al acesteia. Și în ultimul deceniu, înțelegerea noastră a avansat și mai departe, până la punctul că am ajuns să confirmăm existența a aproape toate părțile sale teoretizate.
Astăzi, cercetarea atomică este concentrată pe studierea structurii și funcției materiei la nivel subatomic. Aceasta constă nu numai în identificarea tuturor particulelor subatomice despre care se crede că alcătuiesc un atom, ci și în investigarea forțelor care le guvernează. Acestea includ forțele nucleare puternice, forțele nucleare slabe, electromagnetismul și gravitația. Iată o descriere a tuturor ceea ce am ajuns să aflăm despre atom până acum ...
Structura Atomului:
Modelul nostru actual de atom poate fi defalcat în trei părți componente - protoni, neutroni și electroni. Fiecare dintre aceste părți are o sarcină asociată, protonii purtând o sarcină pozitivă, electronii având o sarcină negativă și neutronii care nu au nicio sarcină netă. În conformitate cu modelul standard al fizicii particulelor, protonii și neutronii alcătuiesc nucleul atomului, în timp ce electronii îl orbitează într-un „nor”.

Electronii dintr-un atom sunt atrași de protonii din nucleu de forța electromagnetică. Electronii pot scăpa de pe orbita lor, dar numai ca răspuns la o sursă externă de energie aplicată. Cu cât este mai aproape orbita electronului de nucleu, cu atât forța atractivă este mai mare; prin urmare, cu atât forța externă este mai puternică necesară pentru a determina scăparea unui electron.
Electronii orbitează nucleul pe multiple orbite, fiecare corespunzând unui anumit nivel de energie al electronului. Electronul își poate schimba starea la un nivel de energie mai mare prin absorbția unui foton cu suficientă energie pentru a-l stimula în noua stare cuantică. De asemenea, un electron într-o stare energetică mai mare poate scădea la o stare de energie mai mică, în timp ce radiază excesul de energie ca foton.
Atomii sunt neutri din punct de vedere electric dacă au un număr egal de protoni și electroni. Atomii care au fie un deficit, fie un surplus de electroni se numesc ioni. Electronii care sunt cei mai îndepărtați de nucleu pot fi transferați în alți atomi din apropiere sau împărțiți între atomi. Prin acest mecanism, atomii sunt capabili să se lege în molecule și alte tipuri de compuși chimici.
Toate aceste trei particule subatomice sunt Fermioni, o clasă de particule asociate cu materie care este fie elementară (electroni), fie compozită (protoni și neutroni) în natură. Aceasta înseamnă că electronii nu au o structură internă cunoscută, în timp ce protonii și neutronii sunt alcătuiți din alte particule subatomice. numite quarks. Există două tipuri de quark în atomi, care au o sarcină electrică fracționată.

Protonii sunt alcătuiți din doi quarkuri „up” (fiecare cu o încărcare de +2/3) și un quark „down” (-1/3), în timp ce neutronii constau dintr-un quark în sus și doi quark în jos. Această distincție reprezintă diferența de sarcină între cele două particule, care rezultă la o sarcină de +1 și, respectiv, 0, în timp ce electronii au o sarcină de -1.
Alte particule subatomice includ Leptons, care se combină cu Fermions pentru a forma blocurile de materie. În prezentul model atomic există șase leptoni: particulele de electroni, muoni și tau și neutronii asociați. Diferitele soiuri de particule Lepton, denumite în mod obișnuit „arome”, sunt diferențiate de mărimile și sarcinile lor, ceea ce influențează nivelul interacțiunilor lor electromagnetice.
Apoi, există Bosons de calibru, care sunt cunoscuți ca „purtători de forță”, deoarece mediază forțele fizice. De exemplu, gluonii sunt responsabili de forța nucleară puternică care ține quark-uri în timp ce bosonii W și Z (încă ipotetic) se consideră a fi responsabili pentru forța nucleară slabă din spatele electromagnetismului. Fotonii sunt particula elementară care formează lumină, în timp ce Bosonul Higgs este responsabil pentru a da masa bosonilor W și Z.
Masă atomică:
Majoritatea masei atomilor provin din protonii și neutronii care alcătuiesc nucleul său. Electronii sunt cele mai puțin masive dintre particulele constitutive ale unui atom, cu o masă de 9,11 x 10-31 kg și o dimensiune prea mică pentru a fi măsurată prin tehnici actuale. Protonii au o masă care este de 1.836 ori mai mare decât cea a electronului, la 1.6726 × 10-27 kg, în timp ce neutronii sunt cei mai masivi dintre cei trei, la 1.6929 × 10-27 kg (1.839 ori masa electronului).

Numărul total de protoni și neutroni dintr-un nucleu al atomilor (numiți „nucleoni”) se numește număr de masă. De exemplu, elementul Carbon-12 este numit așa, deoarece are un număr masic de 12 - derivat din cei 12 nucleoni ai săi (șase protoni și șase neutroni). Cu toate acestea, elementele sunt aranjate și pe baza numerelor lor atomice, care este același cu numărul protonilor găsiți în nucleu. În acest caz, Carbonul are un număr atomic de 6.
Masa reală a unui atom în repaus este foarte greu de măsurat, deoarece chiar și cei mai masivi dintre atomi sunt prea ușori pentru a se exprima în unități convenționale. Ca atare, oamenii de știință folosesc adesea unitatea de masă atomică unită (u) - numită și dalton (Da) - care este definită ca o a doisprezecea parte din masa unui atom neutru liber de carbon-12, care este aproximativ 1,66 × 10-27 kg.
Chimiștii folosesc, de asemenea, alunițe, o unitate definită ca un aluniță a oricărui element având întotdeauna același număr de atomi (aproximativ 6.022 × 1023). Acest număr a fost ales astfel încât dacă un element are o masă atomică de 1 u, un mol de atomi din acel element are o masă apropiată de un gram. Din cauza definiției unității de masă atomică unificată, fiecare atom de carbon-12 are o masă atomică de exact 12 u, deci un aluniță de atomi de carbon-12 cântărește exact 0,012 kg.
Decadere radioactivă:
Orice doi atomi care au același număr de protoni aparțin aceluiași element chimic. Dar atomii cu un număr egal de protoni pot avea un număr diferit de neutroni, care sunt definiți ca fiind izotopi diferiți ai aceluiași element. Acești izotopi sunt adesea instabili și toți cei cu un număr atomic mai mare de 82 sunt cunoscuți ca fiind radioactivi.
Atunci când un element este supus degradării, nucleul său pierde energie prin emiterea de radiații - care poate consta în particule alfa (atomi de heliu), particule beta (pozitroni), raze gamma (energie electromagnetică de înaltă frecvență) și electroni de conversie. Rata cu care un element instabil se descompune este cunoscută sub numele de „timpul de înjumătățire”, care este perioada de timp necesară pentru ca elementul să scadă la jumătate din valoarea sa inițială.
Stabilitatea unui izotop este afectată de raportul protonilor la neutroni. Dintre cele 339 de tipuri diferite de elemente care apar în mod natural pe Pământ, 254 (aproximativ 75%) au fost etichetate drept „izotopi stabili” - adică neafectând descompunerea. Alte 34 de elemente radioactive au timp de înjumătățire mai lungă de 80 de milioane de ani și există, de asemenea, încă de la începutul sistemului solar (de aceea sunt numite „elemente primordiale”).
În cele din urmă, alte 51 de elemente de scurtă durată sunt cunoscute în mod natural, ca „elemente fiice” (adică subproduse nucleare) ale descompunerii altor elemente (cum ar fi radioul din uraniu). În plus, elementele radioactive de scurtă durată pot fi rezultatul proceselor energetice naturale de pe Pământ, cum ar fi bombardarea cu raze cosmice (de exemplu, carbon-14, care apare în atmosfera noastră).
Istoria studiului:
Cele mai cunoscute exemple de teorie atomică provin din Grecia și India antică, unde filosofi precum Democrit au postulat că toată materia era compusă din unități minuscule, indivizibile și indestructibile. Termenul „atom” a fost inventat în Grecia antică și a dat naștere școlii de gândire cunoscută sub numele de „atomism”. Cu toate acestea, această teorie era mai mult un concept filosofic decât unul științific.
Abia în secolul al XIX-lea, teoria atomilor a devenit articulată ca materie științifică, primele experimente bazate pe dovezi fiind efectuate. De exemplu, la începutul anilor 1800, savantul englez John Dalton a folosit conceptul de atom pentru a explica de ce elementele chimice au reacționat în anumite moduri observabile și previzibile.
Dalton a început cu întrebarea de ce au reacționat elementele în raporturi cu numere întregi mici și a ajuns la concluzia că aceste reacții au avut loc în multipli de unități întregi de unități discrete - cu alte cuvinte, atomi. Printr-o serie de experimente care au implicat gaze, Dalton a continuat să dezvolte ceea ce este cunoscută sub numele de Teoria atomică a lui Dalton, care rămâne una dintre pietrele de temelie ale fizicii și chimiei moderne.
Teoria coboară la cinci premise: elementele, în starea lor cea mai pură, constau din particule numite atomi; atomii unui anumit element sunt aceiași, până la ultimul atom; atomii diferitelor elemente pot fi deosebite de greutățile lor atomice; atomii elementelor se unesc pentru a forma compuși chimici; atomii nu pot fi creați sau distruși în reacție chimică, doar gruparea se schimbă vreodată.
Până la sfârșitul secolului 19, oamenii de știință au început să teoretizeze că atomul era format din mai mult de o unitate fundamentală. Cu toate acestea, majoritatea oamenilor de știință s-au aventurat că această unitate ar fi de dimensiunea celui mai mic atom cunoscut - hidrogenul. Și apoi în 1897, printr-o serie de experimente folosind raze catodice, fizicianul J.J. Thompson a anunțat că a descoperit o unitate care era de 1000 de ori mai mică și de 1800 de ori mai ușoară decât un atom de hidrogen.

Experimentele sale au arătat, de asemenea, că erau identice cu particulele emise de efectul fotoelectric și de materialele radioactive. Experimentele ulterioare au relevat că această particulă transporta curent electric prin fire metalice și sarcini electrice negative în interiorul atomilor. De aceea, particula - care a fost numită inițial „corpuscle” - a fost ulterior schimbată în „electron”, după ce a fost prezisă în 1874 particula lui George Johnstone Stoney.
Cu toate acestea, Thomson a postulat, de asemenea, că electronii erau distribuiți în întregul atom, ceea ce era o mare uniformă de încărcare pozitivă. Acesta a devenit cunoscut sub numele de „model de budincă de prune”, care ulterior s-ar dovedi greșit. Aceasta a avut loc în 1909, când fizicienii Hans Gieger și Ernest Marsden (sub conducerea lui Ernest Rutherfod) și-au desfășurat experimentul folosind folie metalică și particule alfa.
În concordanță cu modelul atomic al lui Dalton, ei credeau că particulele alfa vor trece direct prin folie cu o mică deviere. Cu toate acestea, multe dintre particule au fost deviate în unghiuri mai mari de 90 °. Pentru a explica acest lucru, Rutherford a propus ca sarcina pozitivă a atomului să fie concentrată într-un nucleu minuscul din centru.
În 1913, fizicianul Niels Bohr a propus un model în care electronii orbitau nucleul, dar nu putea face acest lucru decât într-un set finit de orbite. El a propus, de asemenea, că electronii ar putea sări între orbite, dar numai în schimbări discrete de energie corespunzătoare absorbției sau radiației unui foton. Acesta nu numai că a rafinat modelul propus de Rutherford, dar a dat naștere și conceptului de atom cuantificat, unde materia se comporta în pachete discrete.

Dezvoltarea spectrometrului de masă - care folosește un magnet pentru a îndoi traiectoria unui fascicul de ioni - a permis masurarea atomilor cu o precizie crescută. Chimistul Francis William Aston a folosit acest instrument pentru a demonstra că izotopii au mase diferite. La rândul său, fizicianul James Chadwick, care în 1932 a propus neutronul ca o modalitate de a explica existența izotopilor.
De-a lungul începutului secolului XX, natura cuantică a atomilor a fost dezvoltată în continuare. În 1922, fizicienii germani Otto Stern și Walther Gerlach au efectuat un experiment în care un fascicul de atomi de argint a fost direcționat printr-un câmp magnetic, care avea scopul de a împărți fasciculul între direcția momentului unghiular (sau rotire).
Cunoscut sub numele de experiment Stern – Gerlach, rezultatele au fost că fasciculul s-a împărțit în două părți, în funcție de dacă spinarea atomilor a fost sau nu orientată în sus sau în jos. În 1926, fizicianul Erwin Schrodinger a folosit ideea ca particulele care se comportă ca undele pentru a dezvolta un model matematic care descria electronii ca forme de undă tridimensionale, mai degrabă decât simple particule.
O consecință a utilizării formelor de undă pentru a descrie particule este că este imposibil din punct de vedere matematic să obțineți valori precise atât pentru poziția cât și pentru momentul unei particule la un moment dat. În același an, Werner Heisenberg a formulat această problemă și a numit-o „principiul incertitudinii”. Potrivit lui Heisenberg, pentru o anumită măsurare exactă a poziției, nu se poate obține decât o serie de valori probabile pentru moment și invers.

În anii 1930, fizicienii au descoperit fisiunea nucleară, datorită experimentelor lui Otto Hahn, Lise Meitner și Otto Frisch. Experimentele lui Hahn au implicat direcționarea neutronilor către atomii de uraniu, în speranța creării unui element transuraniu. În schimb, procesul i-a transformat proba de uraniu-92 (Ur92) în două elemente noi - bariu (B)56) și kripton (Kr27).
Meitner și Frisch au verificat experimentul și l-au atribuit atomilor de uraniu care se împart pentru a forma două elemente cu aceeași greutate atomică totală, un proces care de asemenea a eliberat o cantitate considerabilă de energie prin ruperea legăturilor atomice. În anii care au urmat, au început cercetările privind posibila armare a acestui proces (adică arme nucleare) și au dus la construirea primelor bombe atomice în SUA până în 1945.
În anii '50, dezvoltarea acceleratorilor de particule și a detectoarelor de particule îmbunătățite le-a permis oamenilor de știință să studieze impactul atomilor care se deplasează cu energii mari. Din aceasta a fost elaborat modelul standard al fizicii particulelor, care a explicat până acum cu succes proprietățile nucleului, existența particulelor teoretice subatomice și forțele care guvernează interacțiunile lor.
Experimente moderne:
Începând cu a doua jumătate a secolului XX, multe descoperiri noi și interesante au avut loc în ceea ce privește teoria atomică și mecanica cuantică. De exemplu, în 2012, căutarea îndelungată a Bosonului Higgs a dus la o descoperire în care cercetătorii care lucrează la Organizația Europeană pentru Cercetări Nucleare (CERN) din Elveția și-au anunțat descoperirea.

În ultimele decenii, fizicienii au dedicat o mare cantitate de timp și energie dezvoltării unei teorii de câmp unificate (denumită, de asemenea, Teoria Grand Unificatoare sau Teoria a Totului). În esență, de la prima propunere a modelului standard, oamenii de știință au căutat să înțeleagă cum funcționează împreună cele patru forțe fundamentale ale universului (gravitația, forțele nucleare puternice și slabe și electromagnetismul).
În timp ce gravitația poate fi înțeleasă folosind teoriile relativității ale lui Einstein, iar forțele nucleare și electromagnetismul pot fi înțelese folosind teoria cuantică, nici o teorie nu poate da în calcul toate cele patru forțe care lucrează împreună. Încercările de a rezolva acest lucru au dus la o serie de teorii propuse de-a lungul anilor, variind de la teoria șirurilor la Loop Quantum Gravity. Până în prezent, niciuna dintre aceste teorii nu a dus la un progres.
Înțelegerea noastră a atomului a parcurs un drum lung, de la modelele clasice care l-au văzut ca un solid inert care a interacționat mecanic cu alți atomi, până la teoriile moderne în care atomii sunt compuși din particule energetice care se comportă imprevizibil. Deși au trecut câteva mii de ani, cunoștințele noastre despre structura fundamentală a tuturor materiilor au avansat considerabil.
Și totuși, rămân multe mistere care sunt încă de rezolvat. Cu timpul și eforturile continue, vom putea debloca în sfârșit ultimele secrete rămase ale atomului. Apoi, din nou, s-ar putea foarte bine ca orice noi descoperiri pe care le vom face nu vor face decât să dea naștere la mai multe întrebări - și ar putea fi chiar mai confuze decât cele care au venit înainte!
Am scris multe articole despre atom pentru Space Magazine. Iată un articol despre modelul atomic al lui John Dalton, modelul atomic al lui Neils Bohr, Cine a fost Democrit? Și câți atomi există în univers?
Dacă doriți mai multe informații despre atom, consultați articolul NASA privind analizarea mostrelor mici și iată un link la articolul NASA despre atomi, elemente și izotopi.
Am înregistrat, de asemenea, un întreg episod al distribuției de astronomie despre Atom. Ascultați aici, episodul 164: în interiorul atomului, episodul 263: degradare radioactivă și episodul 394: modelul standard, bosoni.